Le stress est considéré par l’OMS comme l’épidémie mondiale du XXIe siècle. Pendant les périodes critiques du développement, le stress peut entraîner des altérations à long terme des structures cérébrales et des voies de signalisation du stress. Les capacités individuelles d’apprentissage et d’extinction de la peur et de traitement des souvenirs traumatiques peuvent contribuer différemment à l’apparition de troubles neurocognitifs et être modulées par les capacités de résilience. Notre but est de déterminer comment les facteurs biologiques, comportementaux et environnementaux peuvent interagir pour conduire à la perte (ou la préservation) des fonctions cognitives au cours du vieillissement (neuromarqueurs liés au stress). Notre hypothèse est que les événements graves de la vie peuvent mener à une dysrégulation persistante des systèmes de stress, conduisant à une vulnérabilité accrue vis-à-vis des pathologies neuropsychiatriques chez l’adulte et aux troubles cérébraux plus tardifs. L’hypothèse fédératrice des projets de notre groupe est que les biomarqueurs de l’exposition au stress pourraient constituer des facteurs prédictifs robustes du risque de maladie.
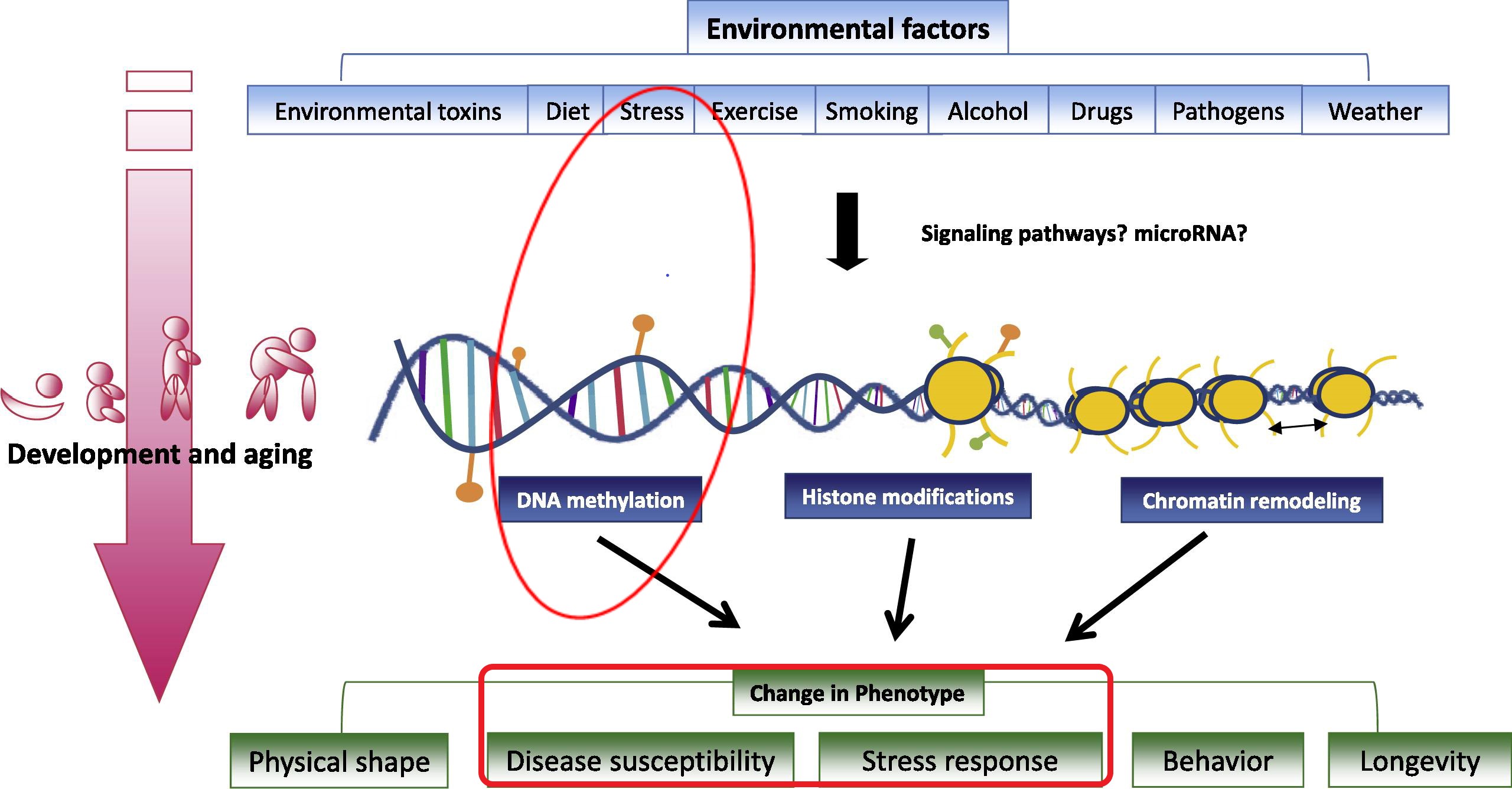
Comment les environnements stressants et les facteurs (épi)génétiques peuvent façonner le phénotype (adapté de Tammen el al., Mol Aspects Med 2013, 34:753)
Principales réalisations
L’originalité de notre recherche réside dans l’étude conjointe des conséquences neuropsychiatriques de la survenue d’événements traumatiques au cours de la vie avec des marqueurs physiologiques de stress (e.g. sécrétion diurne de cortisol, charge allostatique), en tenant compte des spécificités de genre, de la vulnérabilité génétique et des interactions gène-environnement (épigénétique). Nous avons mis en place l’un des plus grands projets épidémiologiques chez les personnes âgées (cohorte ESPRIT) montrant des associations entre la méthylation des régions promoteurs de gènes spécifiques et le risque de dépression (gène codant pour le transporteur de sérotonine, BDNF, IL-6,) ou un dysfonctionnement de l’axe du stress hypothalamique-pituitaire-surrénalien (HPS) (gène ACE, KITLG). Certaines associations varient selon le génotype, ce qui pourrait refléter une hétérogénéité endocrinienne du phénotype et des capacités de résilience spécifiques. Ces marques épigénétiques pourraient constituer des marqueurs périphériques stables de troubles neuropsychiatriques ou de réactivité au stress. Au sein d’une cohorte d’âge moyen à haut risque de développer des troubles neurodégénératifs tardifs (projet PREVENT), nous avons élaboré un modèle original de l’interaction entre les traumas précoces, la dépression, le volume hippocampique et le risque de démence. La vulnérabilité des structures du système limbique aux virus et aux stress environnementaux associés aux épidémies nous conduit aussi au sein de ce projet à suivre les changements cérébraux (IRM) et les biomarqueurs de stress associés à l’exposition au COVID-19.
Recherches actuelles et attendus
- Identification de nouveaux biomarqueurs pathophysiologiques liés au stress, à des stades prodromiques ou précliniques de la maladie et mise en évidence d’endophénotypes potentiels entre facteurs génétiques et phénotypes de la maladie.
- Meilleure compréhension des mécanismes de résilience.
- Identification de cibles innovantes pour des stratégies personnalisées de prévention et d’intervention précoce avec validation possible dans le cadre d’études cliniques.
Méthodes
- Grandes études épidémiologiques (ESPRIT, PHOENIX, PREVENT, 13 novembre), avec de nombreux phénotypages (examens cliniques, IRM, évaluation du stress, biobanques), et complémentaires en termes d’âge, de comorbidités, d’âge de survenue et de nature des traumatismes.
- Marqueurs physiologiques (cortisol, catécholamines, marqueurs métaboliques, inflammation, sommeil) et neuropsychologiques du stress (IRM, IRMf, fonctionnement cognitif, flexibilité mentale), mesures validées de l’exposition au stress (traumatismes au cours de la vie, trouble de stress post-traumatique, soutien social/familial et résilience), vulnérabilité génétique et modifications épigénétiques (méthylation de l’ADN) et autres biomarqueurs (amyloïde, tau, ApoE).
-Modélisation statistique des données censurées, des données longitudinales avec des expositions vie-entière et des tableaux de grande dimension (imagerie cérébrale, génétique…).
Publications principales
Norton J, et al. Psychol Med. Feb 10:1-9, 2021
Ritchie K, Carrière I et al., J Neurol Neurosurg Psychiatry. Oct 21, doi: 10.1136/jnnp-2020-323823, 2020
Ancelin ML et al., Depress Anxiety. 37(2):146-155, 2020
Carles S, Carrière I et al., Alzheimers Dement. Sep 3. doi: 10.1002/alz.12149, 2020
Johnson J et al., Psychoneuroendocrinology. 111:104492, 2020
Ancelin ML et al., J Psychiatry Neurosci. 44(1):45-53, 2019
Norton J, et al. Transl Psychiatry. Nov 11;9(1):291, 2019
Ancelin ML & Ryan J, Mol Psychiatry. 23(11):2116-2117, 2018
Carrière I et al., BMC Med. 15(1):81, 2017
Ancelin ML et al., Neurobiol Stress. 7:38-46, 2017
Ritchie K, Carrière I et al., Alzheimers Dement. 13(10):1089-97, 2017
Gandubert C et al., Neurobiol Stress. 3:61-67, 2016
Ryan J et al., Epigenomics. 8(11):1553-1569, 2016 [Invited review]
Januar V et al., Transl Psychiatry. 5:e619, 2015
Ancelin ML et al., Transl Psychiatry. 5:e499, 2015
Chaudieu I et al., J Clin Psychiatry. 72(7):929-935, 2011
Ritchie K et al., BMJ. 341:c3885, 2010
Davydov DM et al., Clin Psychol Rev. 30(5):479-495, 2010
Collaborations
Francis Eustache & Mickaël Laisney (Inserm UMR1077, Cyceron, Caen, France)
Joanne Ryan & Jerome Maller (Monash University, Australia)
Craig Ritchie (University of Edinburgh, UK)
John O’Brien (University of Cambridge, UK)
Dennis Chan (University College London, UK)
Réseaux internationaux & Consortiums (Alzheimer Cohorts Consortium, APPLE Tree, CHARGE, COSMIC, E3, IGAP, Interlace, Lancet Commission on Dementia, TriBEKa)
Financements
National Health & Medical Research Council (Australia), University of New South Wales/ National Institute of Aging (Australia), NIH (USA), Horizon 2020-IMI, University College London, Alzheimer’s Association UK
Contact




















