Plus de 280 gènes sont impliqués dans des DRH et peuvent entraîner des atteintes rétiniennes isolées ou syndromiques i.e. associées à d’autres symptômes que visuels. De la même manière, plus de 200 gènes sont impliqués dans des formes isolées ou syndromiques de surdité. Depuis l'an 2000, notre groupe réalise le diagnostic moléculaire des cécités et surdités neurosensorielles. La forme syndromique la plus fréquente impliquant un phénotype oculo-auditif est le syndrome de Usher (environ 3 naissances sur 100 000) dans lequel on retrouve une surdité congénitale associée à une rétinite pigmentaire qui apparaît entre la petite enfance et l’âge adulte en fonction des gènes impliqués et des altérations moléculaires (types de variants pathogènes).
Les approches de séquençage de seconde génération et celles plus récentes de troisième génération représentent une véritable révolution pour le diagnostic moléculaire des DRH et des surdités. Notre groupe séquence en routine environ 150 gènes de surdités et de cécités par l’utilisation de panels de gènes. De plus, grâce au plan France Médicine Génomique 2025, les patients atteints de DRH ou de surdité peuvent bénéficier du séquençage de leur génome complet (WGS), avec ou sans séquençage préalable de panel de gènes. L’identification de variants pathogènes dans un des gènes connus, dans le cadre du WGS ou de panels de gènes, nous permet de rendre un diagnostic à la famille.
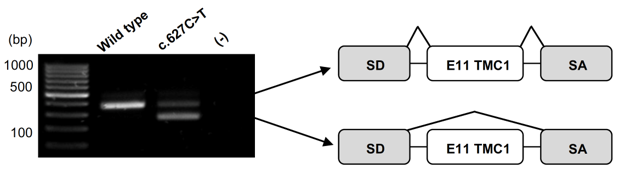
Cependant, de nombreux variants sont considérés comme étant de signification clinique inconnue après analyse et interprétation avec les outils courants, ce qui ne permet pas un rendu diagnostic concluant au patient. Pour certains d’entre eux, il est possible d’évaluer leur effet délétère par des analyses fonctionnelles (notamment pour les variants susceptibles d’altérer l’épissage). Par ailleurs, il apparait aujourd’hui que selon les variants identifiés, certains des gènes connus comme étant impliqués dans des formes syndromiques peuvent aussi aboutir à des formes isolées. Il alors nécessaire de développer des outils permettant d’appréhender ces différents degrés de pathogénicité et d’adapter la prise en charge du patient en conséquence. On peut citer en exemple les gènes USH2A et MYO7A, tous deux impliqués dans le syndrome de Usher, dont certains variants entrainent des formes isolées, i.e. une DRH pour USH2A et une surdité pour MYO7A.
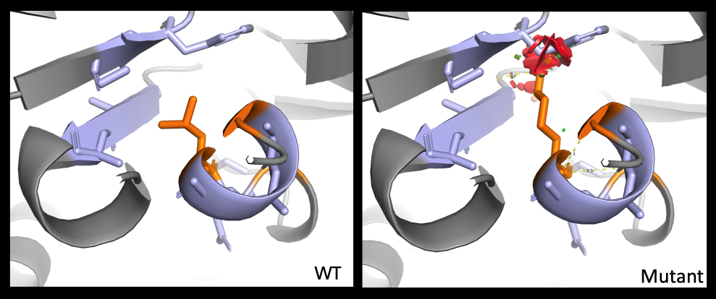
Notre groupe s’intéresse à la caractérisation fine (bioinformatique, tests fonctionnels dits post-génomiques) des variants identifiés dans le cadre du diagnostic des pathologies neurosensorielles afin de pouvoir proposer au patient un diagnostic le plus exhaustif possible, ouvrant la voie aux approches thérapeutiques développées dans l’équipe.
Publications récentes
Vaché et al., Eur J Hum Genet, 31 :834-840, 2023
de Sainte Agathe et al., Hum Genomics, 17 :7, 2023
Mansard L et al., Diagnostics, 12 :207, 2022
Roux AF, Eur J Hum Genet, 30 : 5-6, 2022
Vaché C et al., Eur J Hum Genet, 30 :34-41, 2022
Cenni C et al., Diagnostics, 11 :1636, 2022
Mansard et al., Int J Mol Sci, 22 :1324 , 2021
Baux et al., Eur J Hum Genet, 29 :356-360, 2021
Financements


















