Même si une multitude de neurones récepteurs sensoriels primaires et d’interneurones spinaux sont impliqués dans la détection et la transmission des différentes modalités sensorielles, comment ils apparaissent au cours du développement reste peu compris. Le processus de spécification est l’acquisition des caractéristiques phénotypiques définitives pour une sous-classe donnée de neurones durant le développement. Cette acquisition peut être divisée en plusieurs phases séquentielles et interdépendantes, entre le moment où les cellules progénitrices sortent du cycle cellulaire jusqu’au moment où les neurones nouvellement formés et parfaitement différenciés acquièrent leur fonction physiologique définitive, en passant par des phases d’acquisition de caractéristiques biochimiques spécifiques, une croissance axonale, la survie, la mise en place et la maintenance de la connectivité avec les cibles appropriées.
En fonction de leurs spécificités fonctionnelles, les différents sous-types de neurones de GRD présentent une grande diversité morphologique, moléculaire et électrophysiologique. De même, les mécanismes qui régulent la connectivité précise essentielle à la formation de circuits spinaux transmettant l’information sensitive n’ont pas encore été élucidés.
i) Spécification des sous-types de neurones somatosensoriels : nous utilisons des études neuroanatomiques, électrophysiologiques et comportementales sur des modèles murins transgéniques pour étudier le rôle des membres des familles des facteurs de transcription Maf, Zeb et Meis, facteurs qui sont exprimés dans les sous-types de neurones somatosensoriels.
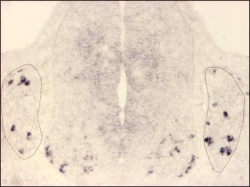
Expression de MafA détectée par hybridation in situ sur une coupe d’un embryon de souris à E11,5.
ii) Connectivité neuronale : pour comprendre comment ces programmes transcriptionnels déterminent la diversité et la connectivité des neurones somatosensoriels, nous avons identifié des molécules effectrices qui pourraient être des cibles potentielles en aval du facteur de spécification des neurones mécanorécepteurs, cMaf. Certains de ces gènes régulés par cMaf codent pour des molécules d'adhésion qui sont exprimées dans le GDR, dans les neurones mécanorécepteurs à bas taux ainsi que dans leurs interneurones cibles putatifs dans la moelle dorsale. Nous testons si ces molécules sont responsables des connexions spécifiques entre les neurones mécanorécepteurs et leurs cibles.
Collaborations
- Dr. S. Valleix (Centre de Recherche Cordeliers CRC, Paris)
- Pr. M. Goulding (Salk Institute, San Diego, USA)
- Dr. G. Lewin (Max-Delbruck Center MDC, Berlin)
Financements


Recherche Translationelle : Meis1 et le Syndrôme des Jambes sans Repos (SJR)
Avec une prévalence de 5 à 10% de la population générale et une incidence croissante avec l'âge, le Syndrôme des Jambes sans Repos (SJR), récemment renommé Maladie de Willis-Ekbom, est associé à des perturbations du sommeil qui altèrent la qualité de vie des patients affectés. Les symptômes de ce désordre sensorimoteur sont liés au rythme circadien et se produisent préférentiellement le soir et la nuit. La physiopathologie de ce syndrôme montre une prédisposition génétique, une réduction de la concentration en fer dans certaines aires du cerveau, ainsi qu'une participation du système dopaminergique, tous ces signes semblant interconnectés. Parmi les facteurs génétiques, l'identification d'un SNP dans le gène Meis1, dont un allèle est associé à un risque plus élevé, suggère que la dérégulation de son expression participe à l'étiologie du SJR. La comorbidité de la maladie de Willis-Ekbom, de maladies cardiovasculaires et d'autres dérégulations métaboliques nous a poussés à poser l'hypothèse que des dysfonctions du système nerveux autonome sont impliquées dans la physiopathologie du SJR et que Meis1 est le lien entre cette maladie, le risque cardiovasculaire et les maladies métaboliques. Le but final de notre projet est donc de lier ces maladies à la protéine à homéobox Meis1, à la fois chez la souris et chez l'humain.
Ce projet est un effort collaboratif impliquant des spécialistes en neurobiologie développementale et en modèles murins génétiquement modifiés (Frédéric Marmigère, UMR1051, Institut des Neurosciences de Montpellier), en physiologie cardiaque (Equipe de Sylvain Richard, Inserm U1046, Canaux et homéostasie du calcium dans les muscles vasculaires et cardiaques, Montpellier) et dans les perturbations du sommeil et maladies associées (Pr Yves Dauvilliers, Unité d Sommeil, Département de Neurologie, Hôpital Gui de Chauliac, Montpellier) et est supporté par l'Association de patients France Ekbom.
 A. F. E. Association France-Ekbom - http://www.france-ekbom.fr/
A. F. E. Association France-Ekbom - http://www.france-ekbom.fr/
Collaborations
- Sylvain Richard team, Inserm U1046, “Channels and calcium homeostasis of cardiac and vascular muscles”, Montpellier
- Pr Yves Dauvilliers, Sleep Unit, Department of Neurology, Gui de Chauliac Hospital, Montpellier
Contact
Publications récentes
Venteo S. et al., Cell Rep. 29(10):2953-2960, 2019
Babski H. et al., Nat Commun. 22;10(1):4796, 2019
Ohayon D. et al., Cell Rep. 17:1473-1481, 2016
Ventéo S. et al., Sci Rep. 6:36407, 2016
Bouilloux F. et al., Elife. 2016 Feb 8;5. pii: e11627, 2016
Ohayon D. et al., Dev Cell. 33:343-50. 2015.




















